Характеристика хімічного елемента КАЛІЮ по плану допоможе підготуватися до заняття.
Характеристика хімічного елемента КАЛІЮ
Калій – позначається символом K – хімічний елемент I групи періодичної системи Менделєєва;
- атомний номер 19,
- атомна маса 39,098;
Калій – сріблясто-білий, дуже легкий, м’який і легкоплавкий метал.
Елемент складається з двох стабільних ізотопів – 39K (93,08%), 41K (6,91%) і одного слабо радіоактивного 40K (0,01%) з періодом напіврозпаду 1,32 · 109 років.
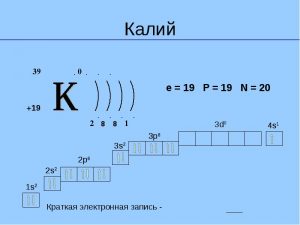
Елемент калій знаходиться в четвертому періоді періодичної системи, значить, всі електрони розташовуються на чотирьох енергетичних рівнях. Таким чином, будова атома калію записується так: + 19к: 2ё; 8ё; 8ё; 1ё.
Виходячи з будови атома, можна передбачити ступінь окислення С1 калію в його з’єднаннях. Так як в хімічних реакціях атом калію віддає один зовнішній електрон, проявляючи відновні властивості, отже, він набуває ступінь окислення +1.
Відновні властивості у калію виражені сильніше, ніж у натрію, але слабкіше, ніж у заліза, що пов’язано з ростом радіусів від Nа до Rb.
Калій – проста речовина, для нього характерна металева кристалічна решітка і металевий хімічний зв’язок, а звідси – і всі типові для металів властивості.
Металеві властивості у калію виражені сильніше, ніж у натрію, але слабкіше, ніж у заліза, тому що атом калію легше віддає електрон, ніж атом натрію, але важче, ніж атом рубідію.
Металеві властивості у калію виражені сильніше, ніж у кальцію, тому що один електрон атома калію легше відірвати, ніж два електрона атома кальцію.
Оксид калію К2О є основним оксидом і проявляє всі типові властивості основних оксидів. Взаємодія з кислотами і кислотними оксидами.
К2O + 2НСl = 2КСl + H2O;
К2O + SO3 = К2SO4
В якості гідроксиду калію відповідає основі (луг) КОН, яка виявляє всі характерні властивості основ: взаємодія з кислотами і кислотними оксидами.
КОН + НNОз = КNO3 + Н2O;
2КОН + H2O5 = 2KNO3 + Н2O.
Летючого водневого з’єднання калій не утворює, а утворює гідрид калію КН
У природі калій зустрічається тільки в з’єднаннях з іншими елементами, наприклад, в морській воді, а також у багатьох мінералах. Він дуже швидко окислюється на повітрі і дуже легко вступає в хімічні реакції, особливо з водою, утворюючи луг. Багато в чому хімічні властивості калію дуже близькі до натрію, але з точки зору біологічної функції і використання їх клітинами живих організмів вони все ж відрізняються.
Якщо ви не знайшли потрібну відповідь, можете запитати у нашого чат-бота у Телеграм.