Реферат на тему “Властивості алкінів” допоможе підготуватися до уроку.
Алкіни– це аліфатичні ненасичені вуглеводні, в молекулах яких між атомами Карбону міститься один потрійний зв’язок –C≡C–.
Загальна формула CnH2n-2
Для алкінів характерними є всі реакції приєднання, властиві алкенам, однак у них після приєднання першої молекули реагенту залишається ще один п-зв’язок (алкін перетворюється на алкен), що може знову вступати в реакцію приєднання з іншою молекулою реагенту. Крім того, «незаміщені» алкіни проявляють кислотні властивості, зумовлені відщепленням протона від атома Карбону, що складає потрійний зв’язок (C-H).
Фізичні властивості алкінів
За фізичними властивостями алкіни нагадують алкени й алкани. Температури їх плавлення й кипіння збільшуються зі зростанням молекулярної маси. За звичайних умов алкіни
C2 — C3 — гази,
C4 — C16 — рідини,
вищі алкіни — тверді речовини. Наявність потрійного зв’язку в ланцюзі приводить до підвищення температури кипіння, густини й розчинності їх у воді порівняно з олефінами й парафінами. Фізичні властивості деяких алкінів наведено в таблиці.
Номенклатура
Назва алкінів за номенклатурою IUPAC утворюються з назв аналогічно побудованих алканів заміною суфіксу -ан на -ин (-ін) із зазначенням цифрою місця розташування потрійного зв’язку. Головний карбоновий ланцюг повинен включати потрійний зв’язок, навіть якщо він не найдовший. Нумерацію ланцюга починають з того кінця, ближче до якого знаходиться потрійний C≡C зв’язок.
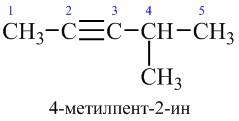
Фізичні властивості деяких алкінів
| Назва | Формула | t°пл, °С | t°кип, °С |
| Ацетилен | HC CH | -80,8 | -83,6 |
| Метилацетилен | CH3 – C CH | -102,7 | -23,3 |
| 1-бутин | C2H5C CH | -122,5 | 8,5 |
| 2-бутин | CH3 – C C – CH3 | -32,3 | 27,0 |
| 1-пентин | CH3 – CH2 – CH2 – C CH | -98,0 | 39,7 |
| 2-пентин | CH3 – CH2 – C C – CH3 | -101,0 | 56,1 |
| 3-метил-1-бутин | – | 28,0 |
Хімічні властивості алкінів
Хімічні властивості алкінів обумовлені наявністю в їхніх молекулах потрійного зв’язку. Типовими реакціями для ацетилену та його гомологів є реакції приєднання. Відмінність алкінів від алкенів полягає в тому, що реакції приєднання можуть протікати у дві стадії. На першій стадії йде приєднання до потрійного зв’язку утворенням подвійного зв’язку, а на другій стадії — приєднання за подвійним зв’язком. Реакції приєднання для алкінів протікають повільніше, ніж для алкенів.
1. Галогенування. Галогени приєднуються до алкінів у дві стадії. Наприклад, приєднання брому до ацетилену призводить до утворення диброметену, який, у свою чергу, реагує з надлишком Вr2 з утворенням тетраброметану:
СН≡СН+Br2→CHBr=CHBr
CHBr=ChBr+Br2→CHBr4-CHBr2
2. Гідрогалогенування. Галогеноводні приєднуються до потрійного зв’язку важче, ніж до подвійного. Для активації галогеноводню використовують АlСl3. З ацетилену при цьому можна добувати вінілхлорид (хлоретен), який використовують для добування важливого полімеру — полівінілхлориду:
СН≡СН+HCl→CH2=CHCl
У разі надлишку галогеноводню відбувається повне гідрогалогенування, причому для несиметричних алкінів на кожній стадії приєднання йде за правилом Марковникова, наприклад:
СН3-C≡СН+2HBr→CH3-CBr2-CH3
3. Гіоратація (реакція Кучерова) Приєднання води до алкінів каталізується солями ртуті (II):
НC≡СН+H2O→[CH2=CH-OH]→CH3-CH=O
На першій стадії реакції утворюється ненасичений спирт, в якому гідроксильна група перебуває безпосередньо в атома Карбону при подвійному зв’язку. Такі спирти заведено називати вініловими, або енолами. Прикметною рисою енолів є їхня нестійкість. У момент утворення вони ізомеризуються в більш стабільні карбонільні сполуки (альдегіди або кетони) за рахунок перенесення протона від гідроксильної групи до сусіднього атома Карбону при подвійному зв’язку. При цьому подвійний зв’язок між атомами Карбону розривається й утворюється подвійний зв’язок з атомом Карбону та атомом Оксигену. Причиною ізомеризації є більша міцність подвійного зв’язку С=О порівняно з подвійним С=С.
У результаті реакції гідратації тільки ацетилен перетворюється в альдегід; гідратація гомологів ацетилену протікає за правилом Марковникова, і утворені еноли ізомеризуються в кетони. Наприклад, пропін перетворюється в ацетон:
CH2-C≡СН+H2O→[CH2-C(OH)=CH2]→CH3-CO=CH3
4. Кислотні властивості. Особливістю алкінів, що мають кінцевий кратний зв’язок, є їхня здатність відщеплювати протон під дією сильних основ, тобто проявляти слабкі кислотні властивості. Таким чином, алкіни, на відміну від алкенів та алканів, здатні утворювати солі, які називають ацетиленідами:
R-C≡С-Н+NaH→R-C≡С-Na+H2
Ацетиленіди Аргентуму и Купруму(I) легко утворюються й випадають в осад при пропусканні ацетилену через аміачний розчин аргентум оксиду або купрум(І) хлориду. Ці реакції слугують для виявлення алкінів з потрійним зв’язком у кінці ланцюга:
HC≡СН+2Ag(NH3)2 OH → Ag-C≡С-Ag↓+4NH3+2H2O (білий осад)
R-C≡СН+[Cu(NH3)2] Cl→R-C≡С-Cu↓+NH4Cl+NH3
Ацетиленіди Арґентуму й Купруму як солі дуже слабких кислот легко розкладаються при дії хлороводневої кислоти з виділенням вихідного алкіну:
R-C≡ С-Cu + HCl → R-C ≡ СH+CuCl
Таким чином, використовуючи реакції утворення й розкладу ацетиленідів, можна виділяти алкіни із сумішей з іншими вуглеводнями.
5. Полімеризація. У присутності каталізаторів алкіни можуть реагувати один з одним, причому залежно від умов утворюються різні продукти. При пропусканні ацетилену над активованим вугіллям при температурі +600 °С відбувається тримеризація ацетилену з утворенням бензену:
2HC≡СН → C6H6
6. Реакції окиснення
а) неповне окиснення
Алкіни легко окиснюються різними окисниками, зокрема калій перманганатом. При реакції розчин калій перманганату знебарвлюється, що свідчить про наявність потрійного зв’язку. При окисненні зазвичай відбувається розщеплення потрійного зв’язку, утворюються карбонові кислоти:
R-C≡ С-R +3[O]+H2O → R-COOH+R -СOOH
б) повне окиснення ( горіння)
7. Реакції відновлення.
У присутності металевих каталізаторів алкіни відновлюються шляхом послідовного приєднання молекул водню, перетворюючись спочатку в алкени, а потім в алкани:
CH3-C ≡ СН+H2→CH3-CH=СH3
CH3-CH = СН2+H2→CH3-CH2-CH3
